Vom Molekül zur Zelle & Wasser ::
Proteine - Teil A ::
Proteine - Teil B ::
Lipide ::
Membranen ::
Glykane und Glycokonjugate ::
Thermodynamische Grundlagen ::
Enzymologie
Lösungen - Proteine - Teil B
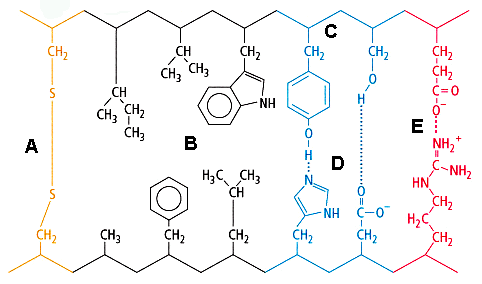
a) In einer 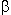 -Schleife kommt die Aminosäure Gly besonders selten vor
-Schleife kommt die Aminosäure Gly besonders selten vor
weil
b) Gly die Drehbarkeit der Peptidkette stark einschränkt.
A) a und b richtig; b als Begründung von a richtig
B) a und b richtig; b als Begründung von a falsch
C) a richtig, b falsch
D) a falsch, b richtig
E) a falsch, b falsch
a) In natürlichen Proteinen kommen ausschliesslich L-Aminosäuren vor
weil
b) D-Aminosäuren keine Sekundärstrukturen ausbilden können.
A) a und b richtig; b als Begründung von a richtig >> D-Aminosäuren können Sekundärstrukturen ausbilden, sie werden in der Natur aber nicht in Proteine eingebaut
B) a und b richtig; b als Begründung von a falsch
C) a richtig, b falsch
D) a falsch, b richtig
E) a falsch, b falsch
a) Van der Waals Bindungen zwischen den Seitenketten im Proteininnern stabilisieren die Tertiärstruktur
weil
b) die polaren Seitenketten bevorzugt an der Oberfläche des Proteins liegen.
A) a und b richtig; b als Begründung von a richtig
B) a und b richtig; b als Begründung von a falsch
C) a richtig, b falsch
D) a falsch, b richtig
E) a falsch, b falsch
a) In einem globulären Protein kommen alle Aminosäuren in a-Helices, ß-Faltblättern oder &beta-Schleifen vor
weil
b) diese Strukturen die Anzahl der H-Brücken zwischen den Peptidbindungen optimieren.
A) a und b richtig; b als Begründung von a richtig >> Nicht alle AS eines Proteins sind Bestandteil von Sekundärstrukturen.
B) a und b richtig; b als Begründung von a falsch >> nicht alle AS eines Proteins sind Bestandteil von Sekundärstrukturen
C) a richtig, b falsch >> Nicht alle AS eines Proteins sind Bestandteil von Sekundärstrukturen.
D) a falsch, b richtig
E) a falsch, b falsch
a) Die Kontaktflächen zwischen den Untereinheiten von Hämoglobin sind komplementär zueinander
weil
b) der hydrophobe Effekt den grössten Energiebeitrag für den Zusammenhalt der Untereinheiten liefert.
A) a und b richtig; b als Begründung von a richtig
B) a und b richtig; b als Begründung von a falsch
C) a richtig, b falsch
D) a falsch, b richtig
E) a falsch, b falsch
a) Bei der Denaturierung bleiben die Sekundärstrukturelemente eines Proteins grossenteils erhalten
weil
b) diese durch sehr viele H-Bindungen stablisiert werden.
A) a und b richtig; b als Begründung von a richtig >> Denaturierung lässt nur die Primärstruktur intakt
B) a und b richtig; b als Begründung von a falsch >> Denaturierung lässt nur die Primärstruktur intakt.
C) a richtig, b falsch >> Denaturierung lässt nur die Primärstruktur intakt.
D) a falsch, b richtig
E) a falsch, b falsch
a) Als chemische Evolution bezeichnet man die Veränderung der Aminosäurensequenz verwandter Proteine aus verschiedenen Spezies
weil
b) die Sequenzunterschiede mit zunehmender evolutionärer Distanz zunehmen.
A) a und b richtig; b als Begründung von a richtig
B) a und b richtig; b als Begründung von a falsch
C) a richtig, b falsch
D) a falsch, b richtig
E) a falsch, b falsch
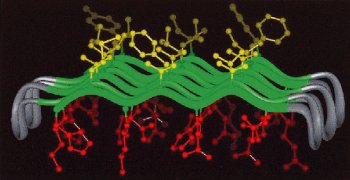
Das antiparallele ß-Faltblatt auf der Abbildung besteht aus 6 Strängen, jeder Strang hat 7 Aminosäuren. Hydrophobe Seitenketten sind gelb, hydrophile rot, das Peptidrückgrat grün und die ß-Schleifen grau. Welcher Sequenzausschnitt entspricht am ehesten dieser Struktur? y = eine hydrophobe Aminosäure, w = eine hydrophile Aminosäure, t = eine Aminosäure in einer ß-Schleife.
A) ....y-y-y-y-w-w-w-t-t-t-t-y-y-y-y-w-w-w-t-t-t-t.... >> Reste, die in der Sequenz benachbart sind, schauen nach oben und nach unten; die Sequenz muss deshalb y-w-y-w... oder w-y-w-y... enthalten
B) ....y-w-y-w-y-w-y-t-t-t-t-y-w-y-w-y-w-y-t-t-t-t.... >> fast richtig, aber es sind je 3 hydrophobe und 4 hydrophile Reste pro Strang, daher muss die Sequenz w-y-w-y-w-y-w lauten; D ist korrekt
C) ....y-y-w-w-y-y-w-t-t-t-t-y-y-w-w-y-y-w-t-t-t-t.... >> Reste, die in der Sequenz benachbart sind, schauen nach oben und nach unten; die Sequenz muss deshalb y-w-y-w... oder w-y-w-y... enthalten
D) ....w-y-w-y-w-y-w-t-t-t-t-w-y-w-y-w-y-w-t-t-t-t....
E) ....w-w-w-w-w-w-w-t-t-t-t-y-y-y-y-y-y-y-t-t-t-t... >> Reste, die in der Sequenz benachbart sind, schauen nach oben und nach unten; die Sequenz muss deshalb y-w-y-w... oder w-y-w-y... enthalten

Welcher Wert entspricht am ehesten der Fläche des in der Abbildung grün gezeichneten 6-strängigen ß-Faltblatts mit je 7 Aminosäuren pro Strang?
A) 100 (Angstrom)2 >> Der Abstand zwischen den AS beträgt 3.5 Angström und zwischen den Strängen etwa 4.7 Angström. Es sind 6 Stränge mit je 7 AS, die Fläche ist also etwa 5×4.7×6×3.5 = etwa 500 Angström^2
B) 500 (Angstrom)2 >> Der Abstand zwischen den AS beträgt 3.5 Angström und zwischen den Strängen etwa 4.7 Angström. Es sind 6 Stränge mit je 7 AS, die Fläche ist also etwa 5×4.7×6×3.5 = etwa 500 Angström^2
C) 1000 (Angstrom)2 >> Der Abstand zwischen den AS beträgt 3.5 Angström und zwischen den Strängen etwa 4.7 Angström. Es sind 6 Stränge mit je 7 AS, die Fläche ist also etwa 5×4.7×6×3.5 = etwa 500 Angström^2
D) 2000 (Angstrom)2 >> Der Abstand zwischen den AS beträgt 3.5 Angström und zwischen den Strängen etwa 4.7 Angström. Es sind 6 Stränge mit je 7 AS, die Fläche ist also etwa 5×4.7×6×3.5 = etwa 500 Angström^2
E) 5000 (Angstrom)2 >> Der Abstand zwischen den AS beträgt 3.5 Angström und zwischen den Strängen etwa 4.7 Angström. Es sind 6 Stränge mit je 7 AS, die Fläche ist also etwa 5×4.7×6×3.5 = etwa 500 Angström^2
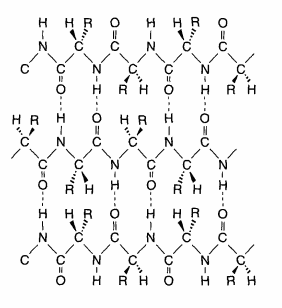
Welche Aussage über diese Struktur ist falsch?
A) Es ist ein antiparalleles Faltblatt.
B) Der Abstand zwischen den Peptidketten beträgt etwa 4.7 Angstrom.
C) Die Seitenketten liegen über und unter der Ebenen der Peptidbindungen.
D) Die Peptidbindungen liegen alle in derselben Ebene senkrecht zur Richtung der Peptidkette. >> Die Ebenen der Peptidbindungen wechseln, daher der Name "Faltblatt"
E) Es handelt sich um eine Struktur aus lauter L-Aminosäuren.
Welche Aussage über Proteindomänen ist falsch?
A) Sie enthalten oft 10-20 Aminosäuren. >> Domänen sind grösser, typisch sind 100-150 Aminosäuren
B) Sie sind oft strukturell unabhängig.
C) Sie haben oft eine spezialisierte Funktion.
D) Sie ähneln oft einem kleinen globulären Protein.
E) Sie werden oft auf der DNA durch ein einzelnes Exon kodiert.
Wieviele H-Bindung mit anderen Aminosäuren macht die 10. Aminosäure in einer a-Helix aus 12 Aminosäuren?
A) 0 >> Die 10. AS kann noch eine H-Bindung machen, denn diese liegen zwischen AS i und i+4
B) 1 >> Die H-Bindungen liegen zwischen der AS i und i+4, daher kann die 10. AS nur noch eine H-Bindung machen
C) 2 >> Die H-Bindungen liegen zwischen der AS i und i+4, daher kann die 10. AS nur noch eine H-Bindung machen
D) 3 >> Eine AS in einer alpha-Helix kann höchstens zwei H-Bindung machen
E) 4 >> Eine AS in einer alpha-Helix kann höchstens zwei H-Bindung machen
Welche Aminosäure einer a-Helix macht eine H-Brücke mit der 2. Aminosäure?
A) 1. Aminosäure >> die H-Bindung liegen zwischen AS i und i+4
B) 3. Aminosäure >> Die H-Bindung liegen zwischen AS i und i+4.
C) 4. Aminosäure >> Die H-Bindung liegen zwischen AS i und i+4.
D) 5. Aminosäure >> Die H-Bindung liegen zwischen AS i und i+4.
E) 6. Aminosäure >> Die H-Bindung liegen zwischen AS i und i+4.
Wieviele verschiedene Disulfidbrücken können in einer Polypeptidkette mit 6 Cysteinresten entstehen?
A) 6 >> 5 x 3 x 1 Möglichkeiten
B) 12 >> 5 x 3 x 1 Möglichkeiten
C) 15 >> 5 x 3 x 1 Möglichkeiten
D) 21 >> 5 x 3 x 1 Möglichkeiten
E) 36 >> 5 x 3 x 1 Möglichkeiten
Welche Aussage über Konformationsänderungen ist falsch?
A) Konformationänderungen werden durch die Bindung von Substraten an Enzyme ausgelöst
B) Konformationsänderungen sind charakterisiert durch die Spaltung und Neubildung von nicht-kovalenten Bindungen
C) Konformationsänderungen sind reversibel
D) Der Energiegehalt der verschiedenen Konformationen eines Proteins ist ähnlich
E) Bei Konformationsänderungen ändert die Sekundärstruktur nicht >> Nur die Primärstruktur ändert bei einer Konformationsänderung nicht
Unter welchen Bedingungen wird ein Protein in der Regel NICHT denaturiert?
A) pH 1
B) 8 M Harnstoff
C) 6 M Guanidiniumhydrochlorid
D) 2 M Kochsalz >> Kochsalz kann zwar die Konformation eines Proteins beeinflussen, aber es wird in der Regel durch Salz nicht denaturiert
E) 100 °C
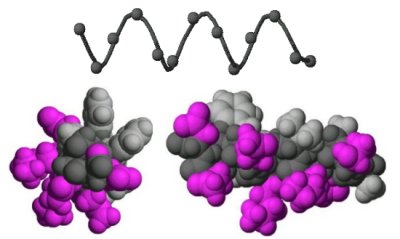
Die gezeigte Helix aus 13 Resten hat eine polare (violett) und eine apolare (grau) Seite. Welche Sequenz entspricht am ehesten dieser Helix? w = polare Aminosäure, y = apolare Aminosäure.
A) w-w-w-w-w-w-w-y-y-y-y-y-y >> 3.6 AS pro Umdrehung: Es können also höchstens 1-2 AS auf der gleichen Seite der Helix liegen
B) w-w-y-y-w-w-y-y-w-w-y-y-w >> 3.6 AS pro Umdrehung: Es können also nicht immer zwei AS auf der gleichen Seite der Helix liegen
C) w-w-w-y-y-y-w-w-w-y-y-y-w >> 3.6 AS pro Umdrehung: Es können also höchstens 1-2 AS auf der gleichen Seite der Helix liegen
D) w-y-w-y-w-y-w-y-w-y-w-y-w >> 3.6 AS pro Umdrehung: Nicht jede zweite AS kann auf der gleichen Seite der Helix liegen
E) y-w-w-y-y-w-w-y-w-w-y-y-w
Welches Merkmal der Quartärstruktur ist falsch?
A) Die Kontaktflächen zwischen den Untereinheiten zeigen eine räumlich komplementäre Struktur
B) Hydrophobe Wechselwirkungen stabilisieren den Zusammenhalt der Untereinheiten
C) H-Bindungen stabilisieren den Zusammenhalt der Untereinheiten
D) Die Quartärstrukturen entsteht spontan durch Selbstorganisation
E) Zur Bildung der Quartästruktur braucht es Untereinheiten mit verschiedenen Sequenzen
Welche Beobachtung zeigt, dass die Information für die native Proteinstruktur in der Aminosäurensequenz enthalten ist?
A) Verdauung des nativen Proteins mit einer Protease zerstört seine biologische Aktivität
B) Kochen des Proteins zerstört seine biologische Aktivität
C) Dialyse des nativen Proteins gegen Puffer von pH 7 zerstört seine biologische Aktivität
D) Dialyse des denaturierten Proteins gegen Puffer von pH 7 bringt seine biologische Aktivität zurück
E) Dialyse des denaturierten Proteins gegen 8 M Harnstofflösung bringt seine biologische Aktivität zurück
Was erklärt die Verklumpung von Hämoglobin S (Sichelzellanämie), die man bei Hämoglobin A (normales Hämoglobin des Erwachsenen) nicht beobachtet?
A) HbS enthält mehr hydrophobe Aminosäuren als HbA
B) HbS enthält mehr hydrophile Aminosäuren als HbA
C) In einer einzigen Position enthält HbS ein Glu anstelle eines Val
D) In einer einzigen Position enthält HbS ein Val anstelle eines Glu
E) HbS bindet Sauerstoff schlechter als HbA
Welche Eigenschaft einer Polypeptidkette ist für die Ausbildung von Sekundärstruktur hauptverantwortlich?
1. Freie Drehbarkeit der Peptidbindung
2. H-Brücken zwischen Seitenketten
3. Beweglichkeit der Seitenketten
4. H-Brücken zwischen Peptidbindungen
A) 1, 2, und 3 treffen zu
B) 1 und 3 treffen zu
C) 2 und 4 treffen zu
D) 4 trifft zu
E) 1, 2, 3 und 4 treffen zu
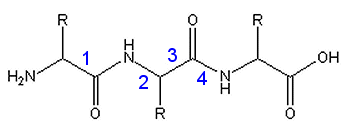
Welche Bindung ist frei drehbar?
1. Bindung 1
2. Bindung 2
3. Bindung 3
4. Bindung 4
A) 1, 2, und 3 treffen zu
B) 1 und 3 treffen zu
C) 2 und 4 treffen zu
D) 4 trifft zu
E) 1, 2, 3 und 4 treffen zu
Welche Aussage über Disulfidbrücken ist richtig?
1. Sie können Peptidketten miteinander verknüpfen
2. Sie stabilisieren vor allem intrazelluläre Proteine
3. Sie können innerhalb einer Peptidkette liegen
4. Sie werden durch Oxidationsmittel gespalten.
A) 1, 2, und 3 treffen zu
B) 1 und 3 treffen zu
C) 2 und 4 treffen zu
D) 4 trifft zu
E) 1, 2, 3 und 4 treffen zu
Welche Aussage über die a-Helix ist richtig?
1. Zwei H-Bindungen pro Peptidbindung
2. Seitenketten gegen aussen gerichtet
3. Ebenen der Peptidbindung parallel zur Helixachse
4. H-Bindung zwischen Aminosäuren i und i+4.
A) 1, 2, und 3 treffen zu
B) 1 und 3 treffen zu
C) 2 und 4 treffen zu
D) 4 trifft zu
E) 1, 2, 3 und 4 treffen zu
Welche Aussage über das 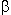 -Faltblatt ist richtig?
-Faltblatt ist richtig?
1. zwei H-Bindungen pro Peptidbindung
2. Seitenketten abwechselnd nach oben und unten gerichtet
3. H-Bindungen senkrecht zur Richtung der Peptidketten
4. H-Bindung zwischen Aminosäuren i und i+3.
A) 1, 2, und 3 treffen zu
B) 1 und 3 treffen zu
C) 2 und 4 treffen zu
D) 4 trifft zu
E) 1, 2, 3 und 4 treffen zu
Welche Aussage über die prosthetische Hämgruppe von Myoglobin ist falsch?
1. Sie ist kovalent mit der Peptidkette verknüpft.
2. Sie liegt an der Oberfläche des Moleküls.
3. Sie ist vorwiegend von polaren Aminosäureseitenketten umgeben.
4. Sie enthält im Zentrum ein Eisen.
A) 1, 2, und 3 treffen zu
B) 1 und 3 treffen zu
C) 2 und 4 treffen zu
D) 4 trifft zu
E) 1, 2, 3 und 4 treffen zu
Welche Aminosäureseitenketten können im Proteininnern nur über van der Waals-Bindungen miteinander interagieren?
1. Val-Ser
2. Val-Leu
3. Ile-Thr
4. Gln-Ser
A) 1, 2, und 3 treffen zu
B) 1 und 3 treffen zu
C) 2 und 4 treffen zu
D) 4 trifft zu >> auch im Innern kann sich eine H-Bindung zwischen den Seitenketten von Gln und Ser ausbilden
E) 1, 2, 3 und 4 treffen zu >> auch im Innern kann sich eine H-Bindung zwischen den Seitenketten von Gln und Ser ausbilden
Welche Aussage über Denaturierung ist falsch?
1. Denaturierung ist immer reversibel
2. Denaturierung zerstört die Primärstruktur nie
3. Bei der Denaturierung fällt das Protein immer aus
4. Denaturierung zerstört stets die biologische Aktivität des Proteins
A) 1, 2, und 3 treffen zu
B) 1 und 3 treffen zu
C) 2 und 4 treffen zu
D) 4 trifft zu
E) 1, 2, 3 und 4 treffen zu
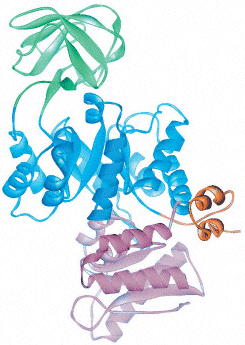
Welche Aussage über das gezeigte Protein ist richtig?
1. Es enthält alpha-Helix und beta-Faltblatt
2. Es enthält keine beta-Schleifen
3. Es ist aus verschiedenen Domänen aufgebaut
4. Es ist etwa 50 Aminosäuren lang.
A) 1, 2 und 3 sind richtig
B) 1 und 3 sind richtig
C) 2 und 4 sind richtig
D) 4 ist richtig
E) alle sind richtig
Welche Aussage über die Flexibilität von Proteinen ist richtig?
1. sie ermöglicht unterschiedliche Konformationen eines Proteins
2. sie ist dafür verantwortlich, dass die meisten Proteine zwischen 50 und 100 °C denaturieren
3. sie trägt zur Spezifität der Enzyme bei
4. sie ist in der Kristallstruktur eines Proteins nicht sichtbar
A) 1, 2 und 3 sind richtig
B) 1 und 3 sind richtig
C) 2 und 4 sind richtig
D) 4 ist richtig
E) alle sind richtig
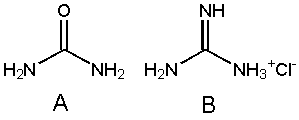
Unter welchen Bedingungen wird ein Protein denaturiert?
1. kochen bei pH 7
2. kochen bei pH 3
3. mit einer konzentrierten Lösung des Moleküls A behandeln
4. mit einer konzentrierten Lösung des Moleküls B behandeln
A) 1, 2 und 3 sind richtig
B) 1 und 3 sind richtig
C) 2 und 4 sind richtig
D) 4 ist richtig
E) alle sind richtig
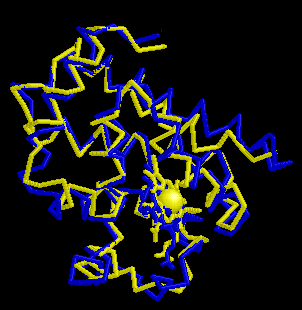
Weshalb sind die Strukturen von Myoglobin (blau) und der alpha-Untereinheit von Hämoglobin (gelb) sehr ähnlich?
1. weil die beiden Proteine ähnliche Sequenzen haben
2. weil die beiden Proteine unter identischen Bedingungen kristallisiert worden sind
3. weil die beiden Proteine in der Evolution aus einem gemeinsamen Vorläuferprotein entstanden sind
4. weil die prosthetische Hämgruppe ähnliche Strukturen erzeugt.
A) 1, 2 und 3 sind richtig
B) 1 und 3 sind richtig
C) 2 und 4 sind richtig
D) 4 ist richtig
E) alle sind richtig
Welche Zuordnungen sind richtig?
A Lineare Abfolge der Aminosäuren
B Räumliche Gesamtstruktur einer Polypeptidkette
C Abschnitte mit regelmässiger Faltung
D Assoziation von mehreren Polypeptidketten
E Kovalente Verknüpfung von Polypeptidketten über Aminosäureseitenketten
A) Disulfidbrücke - E
B) Primärstruktur - A
C) Sekundärstruktur - C
D) Tertiärstruktur - B
E) Quartärstruktur - D

Welche Aussage zu dieser Struktur trifft zu?
1. sie enthält ein antiparalleles Faltblatt
2. Stränge des Faltblatts sind mit einer alpha-Helix verknüpft
3. Stränge des Faltblatts sind mit beta-Schleifen verbunden
4. in der Primärstruktur liegt die alpha-Helix direkt vor dem C-Term
A) 1, 2 und 3 sind richtig
B) 1 und 3 sind richtig
C) 2 und 4 sind richtig
D) 4 ist richtig
E) alle sind richtig
Welche Zuordnung passt am besten?
A hydrophober Effekt
B Kontaktfläche zwischen den Untereinheiten eines oligomeren Proteins
C ionische Bindung
D Proteindomäne
E  -Helix
-Helix
A) räumliche Komplementarität - B
B) Seitenketten von Asp und Arg - C
C) Tendenz von Aminosäuren, den Kontakt mit Wasser zu meiden - A
D) Myoglobin - E
E) Exon auf der DNA - D
Welche Zuordnung ist richtig?
A  -Faltblatt
-Faltblatt
B Coiled Coil
C  -Schleife
-Schleife
D Kollagenhelix
E Keratin
A) Faserprotein mit einer Tripelhelix als Grundstruktur - D
B) Faserprotein mit vielen Disulfidbrücken - E
C) zwei umeinander gewundene 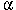 -Helices - B
-Helices - B
D) H-Brücke zwischen der 1. und der 4. Aminosäure - C
E) regelmässige Struktur mit H-Brücken zwischen fast gestreckten Peptidketten - A
Welche Zuordnung ist richtig?
A Chaperone
B Proteasom
C Denaturierung
D Reduktion von Disulfidbrücken
E endoplasmatisches Retikulum
A) HO-CH3-CH2-SH - D
B) NH2-CO-NH2 - C
C) Proteolyse - B
D) Proteinaggregate - A
E) Proteinsynthese - E
Welche Zuordung trifft zu?
A Sichelzellanämie
B Chaperone
C Serinproteasen
D Histone
E Plasmodium falciparum
A) Proteinfaltung - B
B) Bindung an DNA - D
C) basiche Proteine - D
D) molekulare Krankheit - A
E) Malaria - E
Welche Arten von Bindungen und Wechselwirkungen sind mit den Buchstaben A bis E gekennzeichnet??
A) hydrophobe Wechselwirkungen - B
B) elektrostatische Anziehung - E
C) Disulfidbrücke - A
D) kovalente Bindung - C
E) H-Bindungen - D
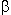 -Schleife kommt die Aminosäure Gly besonders selten vor
-Schleife kommt die Aminosäure Gly besonders selten vor



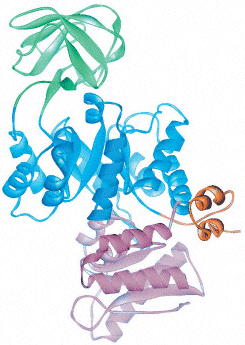
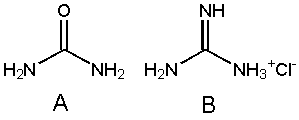


 -Helix
-Helix