Vom Molekül zur Zelle & Wasser ::
Proteine - Teil A ::
Proteine - Teil B ::
Lipide ::
Membranen ::
Glykane und Glycokonjugate ::
Thermodynamische Grundlagen ::
Enzymologie
Lösungen - Thermodynamische Grundlagen
Welche Reaktion ist die wichtigste Energiequelle in heterotrophen Organismen?
A) Hydrolyse von Nährstoffen
B) Oxidation von Nährstoffen
C) Reduktion von Nährstoffen
D) Umwandlung von Nährstoffen in ATP >> Die Umwandlung ist keine Energiequelle
E) keine der obigen Antworten ist richtig
Welche Aussage beschreibt den Begriff "energiereiche Bindung" am besten?
A) die Hydrolyse der Bindung liefert mindestens 20 kJ/mol Energie
B) es braucht viel Energie, um die Bindung zu spalten
C) die Bindung ist stark polar
D) die Hydrolyse der Bindung liefert viel Energie im Vergleich zur Hydrolyse anderer Bindungen
E) die Hydrolyse der Bindung ist exergonisch
Ein Hormon H bindet an einen Rezeptor R.  G der Reaktion ist -26 kJ/mol. Welche Aussage über das Gleichgewicht [HR]/[H][R] trifft am besten zu?
G der Reaktion ist -26 kJ/mol. Welche Aussage über das Gleichgewicht [HR]/[H][R] trifft am besten zu?
A) [HR]/[H][R] > 1000
B) [HR]/[H][R] < 1000
C) [HR]/[H][R] >0
D) [HR]/[H][R] <0
E) [HR]/[H][R] = 0
Welche Aussage trifft für eine spontan ablaufende Redoxreaktion zu?
A)  E ist negativ und
E ist negativ und  G ist positiv
G ist positiv
B)  E ist positiv und
E ist positiv und  G ist negativ
G ist negativ
C)  E ist positiv und
E ist positiv und  G ist positiv
G ist positiv
D)  E ist negativ und
E ist negativ und  G ist negativ
G ist negativ
E)  E = 0 und
E = 0 und  G = 0
G = 0
In welchem Verhältnis steht das Phosphorylgruppen-Übertragungspotential von ATP zum Phosphorylgruppen-Übertragungspotential von anderen energiereichen Verbindungen?
A) es ist am höchsten
B) es ist fast am höchsten
C) es liegt etwa in der Mitte
D) es ist fast am niedrigsten
E) es ist am niedrigsten
Die Reaktion A  B hat ein
B hat ein  G° von +11.4 kJ mol-1.
G° von +11.4 kJ mol-1.
Wie gross ist K°?
A) 0.01
B) 0.1
C) 1
D) 10
E) 100
Die Oxidation von Ethylalkohol zu Acetaldehyd mit NAD+ besteht aus den Halbreaktionen:Acetaldehyd + 2 H+ + 2 e-  Ethylalkohol E°’ = -0.18 V
Ethylalkohol E°’ = -0.18 V
NAD+ + 2 H+ + 2 e-  NADH + H+ E°’ = -0.32 V
NADH + H+ E°’ = -0.32 V
Wie gross ist  E°’ der Oxidation von Ethylalkohol zu Acetaldehyd?
E°’ der Oxidation von Ethylalkohol zu Acetaldehyd?
A) -0.5 V >> Die erste Reaktion in umgekehrter Richtung schreiben und dann die Potentiale addieren gibt -0.14 V
B) +0.5 V >> Die erste Reaktion in umgekehrter Richtung schreiben und dann die Potentiale addieren gibt -0.14 V
C) +0.14 V >> Die erste Reaktion in umgekehrter Richtung schreiben und dann die Potentiale addieren gibt -0.14 V
D) -0.14 V >> Die erste Reaktion in umgekehrter Richtung schreiben und dann die Potentiale addieren gibt -0.14 V
E) -0.25 V >> Die erste Reaktion in umgekehrter Richtung schreiben und dann die Potentiale addieren gibt -0.14 V
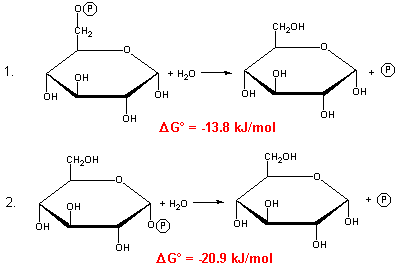
Welche Aussage zu den beiden Reaktion ist falsch?
A) Zur Bildung von 1 Mol Glucose-1-Phosphat aus 1 Mol Glucose und 1 Mol Phosphat sind unter Standardbedingungen +20.9 kJ nötig
B) Reaktion 1 ist schächer exergonisch als Reaktion 2
C) Ist [Glucose] = 10×[Glucose-6-Phosphat], so ist Reaktion 1 exergonisch
D) Reaktion 2 verläuft schneller, weil  G° stärker negativ ist
G° stärker negativ ist
E) Bei beiden Reaktionen werden Phosphorsäureesterbindungen hydrolysiert
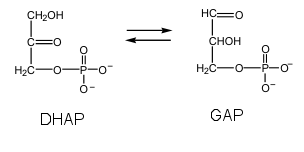
Die Gleichgewichtskonstante der gezeigten Reaktion beträgt 0.0475 unter biochemischen Standardbedingungen. Wie gross ist das Verhältnis [GAP]/[DHAP] bei  G = 0?
G = 0?
A) 1 >> bei deltaG = 0 gelten die Standardbedingungen, das System ist im Gleichgewicht
B) 0.1 >> bei deltaG = 0 gelten die Standardbedingungen, das System ist im Gleichgewicht
C) 0.0475 >> bei deltaG = 0 gelten die Standardbedingungen, das System ist im Gleichgewicht
D) 0.00572 >> bei deltaG = 0 gelten die Standardbedingungen, das System ist im Gleichgewicht
E) 1000 >> bei deltaG = 0 gelten die Standardbedingungen, das System ist im Gleichgewicht
Wie gross ist  G für die Reaktion A + B
G für die Reaktion A + B  C + D, wenn
C + D, wenn  G° = -25 kJ/mol, [A] = [B] = [C] = [D] = 0.001 M?
G° = -25 kJ/mol, [A] = [B] = [C] = [D] = 0.001 M?
A) -50 kJ/mol
B) -25 kJ/mol
C) 0 kJ/mol
D) 25 kJ/mol
E) 50 kJ/mol
Welche Aussage über  G ist richtig?
G ist richtig?
1.  G sagt aus, in welcher Richtung eine Reaktion spontan abläuft
G sagt aus, in welcher Richtung eine Reaktion spontan abläuft
2.  G sagt aus, ob eine Reaktion exotherm oder endotherm ist
G sagt aus, ob eine Reaktion exotherm oder endotherm ist
3.  G ist proportional zum natürlichen Logarithmus der Gleichgewichtskonstante
G ist proportional zum natürlichen Logarithmus der Gleichgewichtskonstante
4.  G ist unabhängig von der Konzentration der Edukte und Produkte der Reaktion
G ist unabhängig von der Konzentration der Edukte und Produkte der Reaktion
A) 1, 2, und 3 treffen zu >> exotherm und endotherm beziehen sich auf die Enthalpieänderung (Wärmeänderung)
B) 1 und 3 treffen zu
C) 2 und 4 treffen zu >> exotherm und endotherm beziehen sich auf die Enthalpieänderung (Wärmeänderung)
D) 4 trifft zu >> deltaG ist konzentrationsabhängig
E) 1, 2, 3 und 4 treffen zu >> exotherm und endotherm beziehen sich auf die Enthalpieänderung (Wärmeänderung) und deltaG ist konzentrationsabhängig
Welche Aussage über die Zustandsfunktionen der Reaktion Glucose  6 CO2 + 6 H2O ist falsch?
6 CO2 + 6 H2O ist falsch?
1. sie sind abhängig von den Konzentrationen von Glucose, CO2 und H2O
2. sie sind abhängig von der Temperatur
3. sie sind Abhängig vom Druck
4. sie sind abhängig von der Anzahl der Zwischenprodukte der Reaktion
A) 1, 2, und 3 treffen zu >> Zustandsfunktionen sind abhängig vom Anfangs- und Endzustand der Reaktion
B) 1 und 3 treffen zu >> Zustandsfunktionen sind abhängig vom Anfangs- und Endzustand der Reaktion
C) 2 und 4 treffen zu >> Zustandsfunktionen sind abhängig vom Anfangs- und Endzustand der Reaktion
D) 4 trifft zu >> Zustandsfunktionen sind unabhängig vom Reaktionsweg
E) 1, 2, 3 und 4 treffen zu
Welche Bedingung gilt für  G° der Reaktion A + B
G° der Reaktion A + B 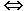 C + D?
C + D?
1. [A] = [B] = [C] = [D] = 1 M
2. T = 25 °C
3. pH = 0
4. p = 1 atm
A) 1, 2, und 3 treffen zu
B) 1 ud 3 treffen zu
C) 2 und 4 treffen zu
D) 4 trifft zu
E) 1, 2, 3 und 4 treffen zu
Welche Feststellung über die gekoppelten Reaktionen ist richtig?
Phosphoenolpyruvat + H2O  Pyruvat + Pa
Pyruvat + Pa  G°’ = -61.9 kJ mol-1
G°’ = -61.9 kJ mol-1
ATP + H2O  ADP + Pa
ADP + Pa  G°’ = -30.5 kJ mol-1
G°’ = -30.5 kJ mol-1
1. Unter Standardbedingungen läuft die Reaktion Phosphoenolpyruvat + ADP  Pyruvat + ATP spontan ab
Pyruvat + ATP spontan ab
2. Die Reaktion Phosphoenolpyruvat + ADP  Pyruvat + ATP wird unter allen Bedingungen spontan ablaufen
Pyruvat + ATP wird unter allen Bedingungen spontan ablaufen
3. Die Reaktion Phosphoenolpyruvat + ADP  Pyruvat + ATP wird spontan ablaufen, wenn [Pyruvat][ATP]/[Phosphoenolpyruvat][ADP] kleiner als die Gleichgewichtskonstante K ist
Pyruvat + ATP wird spontan ablaufen, wenn [Pyruvat][ATP]/[Phosphoenolpyruvat][ADP] kleiner als die Gleichgewichtskonstante K ist
4. Unter Standardbedingungen läuft die Reaktion Pyruvat + ATP  Phosphoenolpyruvat + ADP spontan ab
Phosphoenolpyruvat + ADP spontan ab
A) 1, 2, und 3 treffen zu
B) 1 und 3 treffen zu
C) 2 und 4 treffen zu
D) 4 trifft zu
E) 1, 2, 3 und 4 treffen zu
Wie lässt sich die Richtung der Reaktion A  B, für die
B, für die  G°’ = -5 kJ/mol beträgt, umkehren?
G°’ = -5 kJ/mol beträgt, umkehren?
1. durch Erhöhen der Konzentration von B
2. durch eine sehr lange Reaktionsdauer
3. durch kontinuierliches Entfernen von A
4. durch Zugabe eines Katalysators
A) 1, 2, und 3 treffen zu
B) 1 und 3 treffen zu
C) 2 und 4 treffen zu
D) 4 trifft zu >> ein Katalysator kann die freie Enthalpie nicht verändern
E) 1, 2, 3 und 4 treffen zu
Welche Aussage ist richtig?
1. ATP wird in derjenigen Zelle verbraucht, in der es gebildet wird
2. In der Zelle sind Synthese und Verbrauch von ATP aufeinander abgestimmt
3. ATP kann durch eine Reaktion, deren  G etwa null ist, in andere Nukleosidtriphosphate umgewandelt werden
G etwa null ist, in andere Nukleosidtriphosphate umgewandelt werden
4. Die Hydrolyse von ATP ist unter allen Bedingungen exergonisch
A) 1, 2, und 3 treffen zu
B) 1 und 3 treffen zu
C) 2 und 4 treffen zu
D) 4 trifft zu
E) 1, 2, 3 und 4 treffen zu
Welche Aussage über die Reaktion AMP + ATP 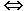 ADP + ADP ist richtig?
ADP + ADP ist richtig?
1. sie ist stark exergonisch
2. sie ist stark endergonisch
3. es handelt sich um eine Esterbildung bezw. -hydrolyse
4. sie wird durch das Enzym Adenylatkinase (Myokinase) katalysiert
A) 1, 2, und 3 treffen zu
B) 1 und 3 treffen zu
C) 2 und 4 treffen zu
D) 4 trifft zu
E) 1, 2, 3 und 4 treffen zu
Welche Aussage über eine Redoxreaktion ist richtig?
1. Eine Redoxreaktion mit einem negativen  E hat ein positives
E hat ein positives  G
G
2. Im thermodynamischen Gleichgewicht ist  G = 0
G = 0
3. Im thermodynamischen Gleichgewicht ist die  E = 0
E = 0
4. Im thermodynamischen Gleichgewicht sind die Geschwindigkeiten der Hin- und Rückreaktion null
A) 1, 2, und 3 treffen zu
B) 1 und 3 treffen zu
C) 2 und 4 treffen zu
D) 4 trifft zu
E) 1, 2, 3 und 4 treffen zu
Welche Aussage über  G°’ ist richtig?
G°’ ist richtig?
1.  G°’ gilt für pH 7
G°’ gilt für pH 7
2.  G°’ ist abhängig von den Konzentrationen der Edukte und Produkte
G°’ ist abhängig von den Konzentrationen der Edukte und Produkte
3.  G°’ hat die Dimension J/mol
G°’ hat die Dimension J/mol
4.  G°’ ist stets grösser als
G°’ ist stets grösser als  G
G
A) 1, 2, und 3 treffen zu
B) 1 und 3 treffen zu
C) 2 und 4 treffen zu
D) 4 trifft zu
E) 1, 2, 3 und 4 treffen zu
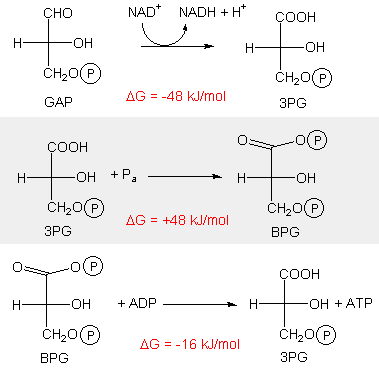
In der Glykolyse sind folgende drei Reaktionen miteinander gekoppelt zu einer Reaktion mit  G = -16 kJ/mol.
G = -16 kJ/mol.
Welche Aussage über die gekoppelte Reaktion ist richtig?
1. sie lautet GAP + Pa + ADP + NAD+  3PG + ATP + NADH + H+
3PG + ATP + NADH + H+
2. die gekoppelte Reaktion läuft spontan ab
3. im Gleichgewicht ist [ATP] > [ADP]
4. im Gleichgewicht ist [BPG] = 0
A) 1, 2, und 3 treffen zu
B) 1 und 3 treffen zu
C) 2 und 4 treffen zu
D) 4 trifft zu
E) 1, 2, 3 und 4 treffen zu
a) Faltet eine Polypeptidekette spontan zur nativen Struktur, so nimmt die Entropie der Polypeptidkette ab,
weil
b)  G der spontanen Faltung negativ ist.
G der spontanen Faltung negativ ist.
A) a und b richtig; b als Begründung von a richtig >> ein negatives deltaG (spontane Faltung) bedeutet nicht zwingend, dass die Entropie abnimmt
B) a und b richtig; b als Begründung von a falsch >> ein negatives deltaG (spontane Faltung) bedeutet nicht zwingend, dass die Entropie abnimmt
C) a richtig, b falsch
D) a falsch, b richtig
E) a falsch, b falsch
a) Damit eine gekoppelte Reaktion spontan abläuft, muss die exergonische Teilreaktion stärker exotherm sein als die endergonische Teilreaktion
weil
b) die freie Enthalpie der gekoppelten Rekation der Summe der freien Enthalpien der beiden Teilreaktionen entspricht.
A) a und b richtig; b als Begründung von a richtig >> Sie haben exotherm mit endergonisch verwechselt
B) a und b richtig; b als Begründung von a falsch >> Sie haben exotherm mit endergonisch verwechselt
C) a richtig, b falsch
D) a falsch, b richtig
E) a falsch, b falsch
a) Eine Reaktion mit einem positiven  G°’ kann unter Nicht-Standardbedingungen spontan ablaufen
G°’ kann unter Nicht-Standardbedingungen spontan ablaufen
weil
b) die Richtung einer Reaktion nicht nur durch die Gleichgewichtskonstante K’, sondern auch durch die Konzentration der Edukte und Produkte zu Beginn der Reaktion bestimmt wird.
A) a und b richtig; b als Begründung von a richtig
B) a und b richtig; b als Begründung von a falsch
C) a richtig, b falsch
D) a falsch, b richtig
E) a falsch, b falsch
a) Je negativer  G, desto schneller verläuft eine chemische Reaktion,
G, desto schneller verläuft eine chemische Reaktion,
weil
b) das Gleichgewicht bei negativerem  G stärker auf der Seite der Produkte liegt.
G stärker auf der Seite der Produkte liegt.
A) a und b richtig; b als Begründung von a richtig >> thermodynamische Zustandsfunktionen sagen nichts aus über die Reaktionsgeschwindigkeit
B) a und b richtig; b als Begründung von a falsch >> thermodynamische Zustandsfunktionen sagen nichts aus über die Reaktionsgeschwindigkeit
C) a richtig, b falsch >> thermodynamische Zustandsfunktionen sagen nichts aus über die Reaktionsgeschwindigkeit
D) a falsch, b richtig >> thermodynamische Zustandsfunktionen sagen nichts aus über die Reaktionsgeschwindigkeit
E) a falsch, b falsch >> thermodynamische Zustandsfunktionen sagen nichts aus über die Reaktionsgeschwindigkeit
a) Im Gleichgewicht ist  G der Reaktion A + B
G der Reaktion A + B 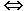 C + D null,
C + D null,
weil
b) im Gleichgewicht  G =
G =  G° + RTln([C][D])/([A][B]).
G° + RTln([C][D])/([A][B]).
A) a und b richtig; b als Begründung von a richtig >> b) ist zwar richtig, aber die Definition des thermodynamischen Gleichgewichts lautet deltaG = 0
B) a und b richtig; b als Begründung von a falsch >> b) ist zwar richtig, aber die Definition des thermodynamischen Gleichgewichts lautet deltaG = 0
C) a richtig, b falsch
D) a falsch, b richtig
E) a falsch, b falsch
Zuordnung:
A ATP + H2O  ADP + Pa
ADP + Pa
B PPa + H2O  2 Pa
2 Pa
C AMP + ATP  2 ADP
2 ADP
D ATP + Glucose  Glucose-6-P + ADP
Glucose-6-P + ADP
E ATP + CDP  ADP + CTP
ADP + CTP
A) Nukleosiddiphosphatkinase - E
B) Adenylatkinase - C
C) Pyrophosphatase - B
D) Hexokinase - D
E) Hydrolyse von ATP - A
Zuordnung:
A Fliessgleichgewicht
B thermodynamisches Gleichgewicht
C Redoxreaktion
D gekoppelte Reaktionen
E energiereiche Bindung
A) [Substrat] = konstant - A
B)  G = 0 - B
G = 0 - B
C)  G1 +
G1 +  G2 < 0 - D
G2 < 0 - D
D)  G°’ = -nF
G°’ = -nF E0’ - C
E0’ - C
E) Anhydridbinding - E
 Ethylalkohol E°’ = -0.18 V
Ethylalkohol E°’ = -0.18 V G der Reaktion ist -26 kJ/mol. Welche Aussage über das Gleichgewicht [HR]/[H][R] trifft am besten zu?
G der Reaktion ist -26 kJ/mol. Welche Aussage über das Gleichgewicht [HR]/[H][R] trifft am besten zu? E ist negativ und
E ist negativ und  G ist positiv
G ist positiv E ist positiv und
E ist positiv und  G ist negativ
G ist negativ E ist positiv und
E ist positiv und  G ist positiv
G ist positiv E ist negativ und
E ist negativ und  G ist negativ
G ist negativ E = 0 und
E = 0 und  G = 0
G = 0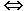 B hat ein
B hat ein  G° von +11.4 kJ mol-1.
G° von +11.4 kJ mol-1. Ethylalkohol E°’ = -0.18 V
Ethylalkohol E°’ = -0.18 V NADH + H+ E°’ = -0.32 V
NADH + H+ E°’ = -0.32 V E°’ der Oxidation von Ethylalkohol zu Acetaldehyd?
E°’ der Oxidation von Ethylalkohol zu Acetaldehyd?
 G° stärker negativ ist
G° stärker negativ ist
 G = 0?
G = 0? G für die Reaktion A + B
G für die Reaktion A + B 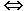 C + D, wenn
C + D, wenn  G° = -25 kJ/mol, [A] = [B] = [C] = [D] = 0.001 M?
G° = -25 kJ/mol, [A] = [B] = [C] = [D] = 0.001 M? G ist richtig?
G ist richtig? G sagt aus, in welcher Richtung eine Reaktion spontan abläuft
G sagt aus, in welcher Richtung eine Reaktion spontan abläuft G sagt aus, ob eine Reaktion exotherm oder endotherm ist
G sagt aus, ob eine Reaktion exotherm oder endotherm ist G ist proportional zum natürlichen Logarithmus der Gleichgewichtskonstante
G ist proportional zum natürlichen Logarithmus der Gleichgewichtskonstante G ist unabhängig von der Konzentration der Edukte und Produkte der Reaktion
G ist unabhängig von der Konzentration der Edukte und Produkte der Reaktion 6 CO2 + 6 H2O ist falsch?
6 CO2 + 6 H2O ist falsch? G° der Reaktion A + B
G° der Reaktion A + B 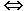 C + D?
C + D? Pyruvat + Pa
Pyruvat + Pa  G°’ = -61.9 kJ mol-1
G°’ = -61.9 kJ mol-1 ADP + Pa
ADP + Pa  G°’ = -30.5 kJ mol-1
G°’ = -30.5 kJ mol-1 Pyruvat + ATP spontan ab
Pyruvat + ATP spontan ab Pyruvat + ATP wird unter allen Bedingungen spontan ablaufen
Pyruvat + ATP wird unter allen Bedingungen spontan ablaufen Pyruvat + ATP wird spontan ablaufen, wenn [Pyruvat][ATP]/[Phosphoenolpyruvat][ADP] kleiner als die Gleichgewichtskonstante K ist
Pyruvat + ATP wird spontan ablaufen, wenn [Pyruvat][ATP]/[Phosphoenolpyruvat][ADP] kleiner als die Gleichgewichtskonstante K ist Phosphoenolpyruvat + ADP spontan ab
Phosphoenolpyruvat + ADP spontan ab B, für die
B, für die  G°’ = -5 kJ/mol beträgt, umkehren?
G°’ = -5 kJ/mol beträgt, umkehren? G etwa null ist, in andere Nukleosidtriphosphate umgewandelt werden
G etwa null ist, in andere Nukleosidtriphosphate umgewandelt werden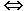 ADP + ADP ist richtig?
ADP + ADP ist richtig? E hat ein positives
E hat ein positives  G
G G = 0
G = 0 E = 0
E = 0 G°’ ist richtig?
G°’ ist richtig? G°’ gilt für pH 7
G°’ gilt für pH 7 G°’ ist abhängig von den Konzentrationen der Edukte und Produkte
G°’ ist abhängig von den Konzentrationen der Edukte und Produkte G°’ hat die Dimension J/mol
G°’ hat die Dimension J/mol G°’ ist stets grösser als
G°’ ist stets grösser als  G
G
 G = -16 kJ/mol.
G = -16 kJ/mol. 3PG + ATP + NADH + H+
3PG + ATP + NADH + H+ G der spontanen Faltung negativ ist.
G der spontanen Faltung negativ ist. G°’ kann unter Nicht-Standardbedingungen spontan ablaufen
G°’ kann unter Nicht-Standardbedingungen spontan ablaufen G, desto schneller verläuft eine chemische Reaktion,
G, desto schneller verläuft eine chemische Reaktion, G stärker auf der Seite der Produkte liegt.
G stärker auf der Seite der Produkte liegt. G der Reaktion A + B
G der Reaktion A + B 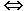 C + D null,
C + D null, G =
G =  G° + RTln([C][D])/([A][B]).
G° + RTln([C][D])/([A][B]). ADP + Pa
ADP + Pa 2 Pa
2 Pa 2 ADP
2 ADP Glucose-6-P + ADP
Glucose-6-P + ADP ADP + CTP
ADP + CTP G = 0 - B
G = 0 - B G1 +
G1 +  G2 < 0 - D
G2 < 0 - D G°’ = -nF
G°’ = -nF E0’ - C
E0’ - C